La validación en la industria farmacéutica , en términos generales, se puede describir como la evidencia documentada de que un sistema o proceso es compatible y, por lo tanto, puede replicar resultados consistentes, asegurando la calidad del fármaco.
El concepto de validación se puede aplicar a varias etapas del cadena de valor de la industria farmacéutica, no siendo exclusivamente aplicable al proceso de manufactura del producto, sino a todos los sistemas, procedimientos y elementos involucrados en su producción, como por ejemplo a:
- Proceso y producto
- Instalaciones
- Limpieza
- Sistemas automatizados
- Equipamiento
- Métodos de prueba
Por lo tanto, se debe entender que la consistencia y la calidad del proceso no se pueden garantizar únicamente mediante la inspección o prueba del producto terminado o en proceso, sino que es necesario tener en cuenta todos los elementos que intervienen a lo largo de la fabricación de un medicamento en el que cada paso se controla para asegurar que el producto final cumpla con todos los requisitos de calidad [1] (desde los métodos utilizados para probar la calidad del producto, hasta el equipo utilizado en su producción).
A través de la validación, es posible lograr un estudio completo del sistema que garantice la uniformidad y coherencia del proceso productivo, ya que se utilizan enfoques basados en posibles riesgos para determinar el peor de los casos y todos los riesgos que posiblemente puedan comprometer la calidad y seguridad del producto.
La validación de un sistema o proceso es importante para que se pueda asegurar que el producto fabricado bajo las condiciones, controles, parámetros, equipos, etc. validados, no experimenta variación en la calidad del producto y se obtiene la máxima consistencia lote tras lote [1].
Las pautas de la FDA (Administración de Alimentos y Medicamentos), adoptadas por las industrias del sector life science a nivel mundial, sugieren que la validación del proceso se puede dividir en tres etapas principales, “que establecen evidencia científica de que un proceso es capaz de entregar un producto de calidad de manera consistente” [1]:
- Diseño del proceso: diseñar un proceso de fabricación que sea capaz de entregar de manera consistente un producto con las especificaciones requeridas y la calidad del producto.
- Calificación del proceso: evaluación del diseño del proceso para determinar si es capaz de reproducirse a lo largo de las diferentes etapas del ciclo de producción: instalaciones, sistemas, equipos, rendimiento, etc.
- Verificación continua del proceso: evaluación continua del proceso para asegurar que permanece en un estado controlado y validado, identificando posibles desviaciones y, en caso necesario, acciones correctivas o preventivas (CAPA).
Como se puede ver, la validación de procesos no se debe realizar como un evento puntual. Es necesario abordarla como un enfoque del ciclo de vida, con estudio continuo y mejora del proceso en sí, entendiendo dónde pueden aparecer las fuentes de variabilidad para eliminarlas durante las iteraciones del sistema o proceso. Después de su validación inicial en la segunda etapa, será necesario realizar revisiones periódicas del sistema en base a las modificaciones y a la identificación de mejoras y riesgos durante la etapa activa del proceso.
Tanto la calificación del proceso, como la verificación continua, responden a un modelo de validación por etapas conocido como modelo V. Dependiendo de la etapa (inicial o periódica), la intensidad y volumen de pruebas a realizar variará en función de los elementos no validados en el sistema o proceso. Igualmente, la identificación de riesgos aumentará el volumen de validación a ejecutar.
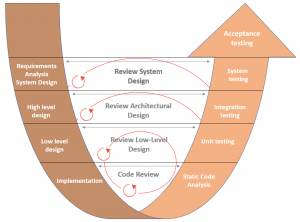
El diagrama presentado arriba corresponde con el modelo V, adaptado específicamente para la validación de software informáticos. Actualmente, este tipo de sistemas tiene una gran relevancia en procesos productivos de la industria Life Science, ya que cada vez más aumenta la relación entre sistemas informáticos y procesos productivos del sector. Cualquier sistema que gestione datos relacionados a parámetros de producto o que su uso se relacione con procesos de producción, podrán afectar directa o indirectamente a la calidad del mismo. Por lo tanto, garantizar la coherencia y uniformidad de los resultados y datos controlados por sistemas es una de las piedras angulares de la validación actualmente.
Para la división de Life Science de ALTEN, la validación representa un foco de actividad debido a la importancia que tiene este proceso en la industria. Tanto la validación de sistemas, limpiezas, software y transporte, cómo la cualificación de equipos, instalaciones y servicios son proyectos que se gestionan de forma frecuente y exitosa desde ALTEN, partiendo desde diferentes enfoques para proveer soluciones a las necesidades de nuestros clientes. Un equipo formado por especialistas de procesos productivos, cualificaciones, validaciones, ingeniería y CSV, permite a ALTEN afrontar retos complejos y proveer servicios de calidad, que ayudan a garantizar la coherencia y confiabilidad de productos directamente vinculados a la salud de los pacientes.
Referencias: [1] Guidance for Industry – Process Validation: General Principles and Practices – Food and Drug Administration, Enero 2011









